Chapitre II : Les ions, des particules chargées
I. Les ions
Si un atome ou une molécule perd (ou gagne) un ou plusieurs électrons, on obtient un ion.
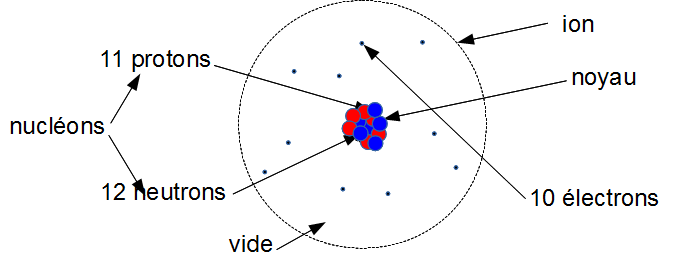
1. L'ion sodium
C'est un atome de sodium qui a perdu 1 électron.
Il ne lui reste que 10 électrons.
${{10~électrons~(-)} \\ {11~protons~(+)}} \\ -> 1~(+)$
L'ion sodium porte globalement une charge (+).
On le note Na + .
(le symbole de l'atome de sodium est Na).
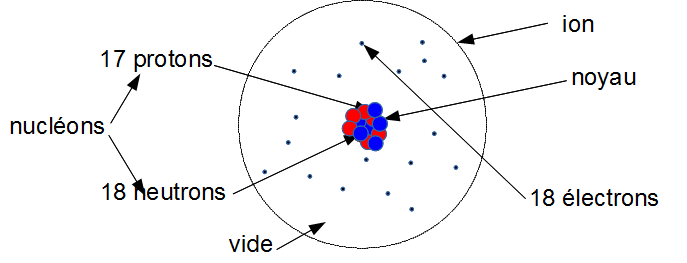
2. L'ion chlorure
C'est un atome de chlore qui a gagné 1 électron
Il a donc 18 électrons maintenant.
${{18~électrons~(-)} \\ {17~protons~(+)}} \\ -> 1~(-)$
On le note Cl - .
3. Les ions les plus courants (ne pas apprendre par coeur)
| Ion hydrogène | $H^+$ |
| Ion hydroxyde | $HO^-$ |
| Ion sodium | $Na^+$ |
| Ion chlorure | $Cl^-$ |
| Ion cuivre II | $Cu^{2+}$ |
| Ion sulfate | $SO_4^{2-}$ |
| Ion fer II | $Fe^{2+}$ |
| Ion fer III | $Fe^{3+}$ |
L'ion fer II est un atome de fer qui a perdu 2 électrons.
L'ion fer III est un atome de fer qui a perdu 3 électrons.
L'ion sulfate est une molécule SO4 qui a gagné 2 électrons.
Le sulfate de cuivre solide : CuSO4 Une solution de sulfate de cuivre : Cu2+ ; SO4 2- .
Les ions négatifs sont appelés anions.
Les ions positifs sont appelés cations.
II. Identification des ions
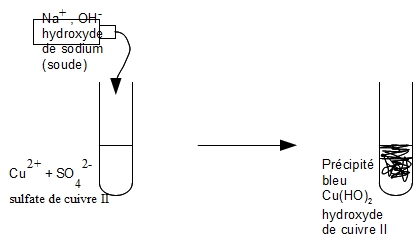
1. Test de l'ion cuivre II
On identifie l'ion cuivre II par l'apparition d'un précipité bleu en présence de soude (hydroxyde de sodium).
2. Test de l'ion fer II
On identifie l'ion fer II par l'apparition d'un précipité vert en présence de soude (hydroxyde de sodium).
3. Test de l'ion fer III
On identifie l'ion fer III par l'apparition d'un précipité rouille en présence de soude (hydroxyde de sodium).