Ceci est une ancienne révision du document !
Pile Zinc cuivre
I. Réaction chimique et transformation d'énergie
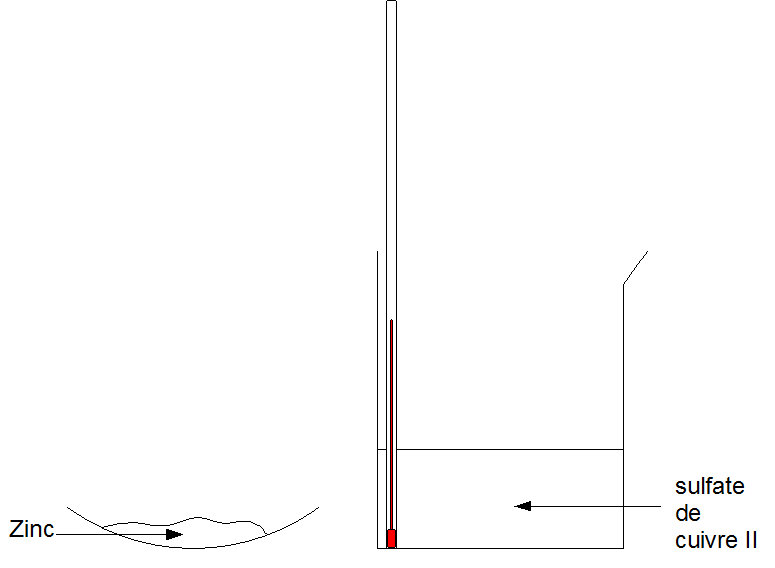
On verse le zinc (métal) dans le sulfate de cuivre II.
On observe une élévation de température : de l'énergie thermique a été libérée.
La couleur bleue a disparu : il y a eu disparition de l'ion cuivre II.
On observe un dépôt de cuivre sur le zinc : du métal cuivre s'est formé.
Il y a donc eu réaction chimique.
La réaction chimique entre la poudre de zinc et le sulfate de cuivre transforme l'énergie chimique de ces réactifs en énergie thermique.
II. Pile électrochimique
La valeur mesurée est positive donc la borne V du voltmètre est reliée à la borne + de la pile.
La borne + est donc le cuivre et la borne -, le zinc.
Les espèces chimiques présentes dans une pile contiennent de l'énergie chimique dont une partie est transformée en d'autres formes d'énergie lorsqu'elle fonctionne.
L'énergie mise en jeu dans une pile provient d'une réaction chimique : la consommation des réactifs entraîne l'usure de la pile.