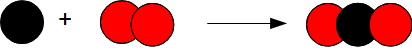Ceci est une ancienne révision du document !
Semaine du 29/05/2023 4C 4A
1. Test sur polluants et réchauffement climatique et molécules
2. Suite de la leçon
II. Modélisation d'une transformation chimique
1. La masse et la réaction chimique
La craie disparaît et il y a une effervescence qui montre qu'un gaz se produit : une réaction chimique a lieu. La masse totale ne varie pas. Les atomes présents dans les produits sont ceux qui composaient les réactifs.
Lors d'une réaction chimique, il y a conservation des atomes donc de la masse.
2.2. Combustion du carbone
La combustion du carbone dans le dioxygène produit du dioxyde de carbone.
C + O2 —→ CO2
2.3. Combustion du méthane
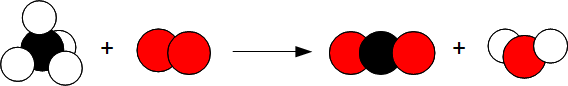
Lors de la combustion du méthane dans le dioxygène, il se produit du dioxyde de carbone et de l'eau.
CH4 + O2 —> CO2 + H2 O
Il y a un problème : 1 atome d'oxygène a disparu et 2 atomes d'hydogène ont disparus. Or la masse se conserve lors d'une réaction chimique donc les atomes ne peuvent pas apparaître ni disparaître.
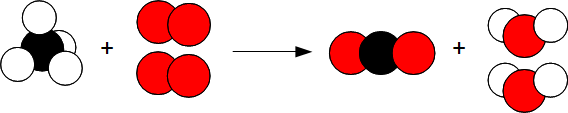
En réalité il se passe la réaction suivante :
Donc
CH4 + 2 O2 —> CO2 + 2 H2 O
2.4. Combustion du fer
Le fer brûle dans le dioxygène pour former un oxyde de fer.*
Fe + O2 —> Fe3 O4
après équilibrage :
3Fe + 2O2 —> Fe3 O4
3. A faire pour la semaine prochaine
Ex 10 - 13 - 14 p 84 85