Ceci est une ancienne révision du document !
Semaine du 8/05/2023
1. Test calculs pourcentage avec comme thème l'air
Il y a des exercices du même type que ça :
Ex 7 p 54 (calculer le pourcentage de chaque molécule dans chaque bocal)
Ex 5 p 54
Ex 10 p 55
2. Leçon suite et fin Chp III
III. Que contient l'air pollué ?
Certains gaz de l'atmosphère réduisent les pertes de chaleur vers l'espace (effet de serre). Cela entraîne le réchauffement climatique.
Ces gaz sont appelés gaz à effet de serre :
- dioxyde de carbone (produit par des combustions)
- méthane et protoxyde d'azote (produit par la décomposition de matières organiques et dans l'agriculture)
- halocarbures (appareils frigorifiques)
L'air, lorsqu'il est pollué peut aussi contenir
- d'autres gaz, comme l'ozone, le dioxyde d’azote et le dioxyde de soufre qui proviennent de l'activité humaine.
- de petites particules solides, les particules fines (ou fumées).
Ces polluants sont souvent irritants et nocifs pour l'appareil pulmonaire et les yeux. Ils peuvent entraîner des cancers.
3. Leçon Chp IV
Chapitre IV : Mélanges et transformations de la matière
Rappel sur le test de l'eau de chaux qui permet d'identifier le dioxyde de carbone :
…
I. Mélanges et transformations de la matière
1. Mélanges
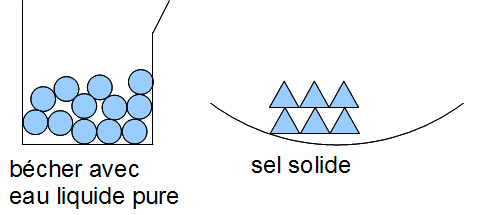
Si on met en contact 2 substances qui ne réagissent pas ensemble, on obtient un mélange.
Les molécules restent identiques.
Ex : mélange d'eau et de sucre
2. Transformation chimique
a. Combustion du carbone dans l'air
Le carbone brûle difficilement dans l'air.
L'air est un mélange constitué d'environ de 80% de diazote et d'environ 20% de dioxygène .
b. Combustion du carbone dans le dioxygène pur
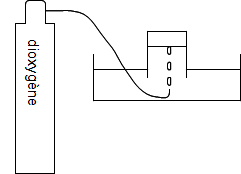
Comment remplir le bocal de dioxygène pur ?
Par déplacement d'eau
Par déplacement d'air
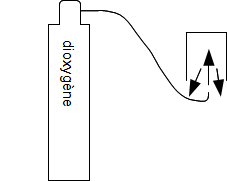
Test de la buchette incandescente pour tester la présence de dioxygène pur :
c. La combustion du carbone dans le dioxygène pur.
Lors de la combustion, le carbone disparaît.
Une bûchette incandescente ne se rallume pas donc le dioxygène a disparu.
Lorsqu'on met de l'eau de chaux, elle se trouble. Il s'est donc formé du dioxyde de carbone.
Le carbone (combustible) réagit avec le dioxygène (comburant) pour former du dioxyde de carbone.
Bilan de la combustion :
| réaction chimique | ||
| carbone + dioxygène | —————————> | dioxyde de carbone |
| réactifs (ils réagissent et sont consommés) | produit (il se forme) |
c. Conclusion
Quand on mets en contact certaines substances, il peut y avoir transformation chimique :
- les réactifs vont être consommés
- les produits se forment
Les molécules ne sont pas les mêmes avant et après la transformation.
Ex : combustion du charbon, fabrication de caramel à partir de sucre
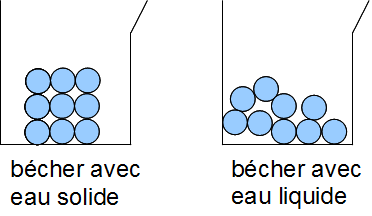
3. Transformation physique
Lors d'une transformation physique, une substance change de forme ou d'aspect mais garde la même composition.
Les molécules restent identiques mais elles changent de disposition.
Ex : de l'eau liquide transformée en vapeur
II. La conservation de la masse
1. La conservation de la masse lors des mélanges en solutions aqueuses
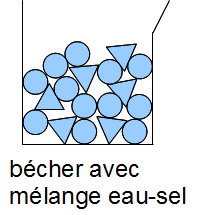
On mesure la masse de l'eau et du sel avant le mélange.
On mesure la masse de l'eau salée.
La masse n'a pas varié.
Interprétation :
Le nombre de molécule ne change pas, donc la masse ne change pas non plus.
2. La conservation de la masse lors d'un changement d'état de l'eau (transformation physique)
On mesure la masse d'un glaçon.
On le fait fondre. On mesure la masse de l'eau liquide obtenue.
La masse n'a pas varié.
Le nombre de molécule ne change pas, donc la masse ne change pas non plus.
3. Conservation de la masse lors d'une transformation chimique
Lors d'une transformation chimique, la masse se conserve. Les molécules ont changé et on explique au chapitre suivant pourquoi cette masse ne varie pas.
4. A faire pour la semaine prochaine
Activité p 60
Test sur le chp III