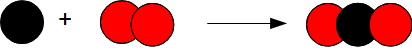Ceci est une ancienne révision du document !
Semaine du 06/06/22
1. Correction des activités
Activité p 74
Activité p 74
1. 1 atome d'oxygène et 2 atome d'hydrogène
2. Atome d'oxygène : O (boule rouge)
Atome d'azote : N (boule bleue)
Atome de carbone : C (boule noire)
3.
| Nom | représentation | formule | composition atomique |
|---|---|---|---|
| dioxygène | 2 boules rouges | 02 | 2 atomes d'oxygène |
| diazote | 2 boules bleues | N2 | 2 atomes d'azote |
| dihydrogène | 2 boules blanches | H2 | 2 atomes d'hydrogène |
| dioxyde de carbone | 1 boule noire 2 boules rouges | CO2 | 1 atome de carbone 2 atomes d'oxygène |
4. Une molécule est composée d'atomes
On la représente par des boules de couleurs (modèle moléculaire) et une formule chimique.
Activité p 75
1. Dimitri Mendeleëv
Certains éléments n'étaient pas encore découverts.
2. 63 atomes contre 118 aujourd'hui
3. Symbole chimique Fer : Fe
Symbole chimique Fluor : F
4. C : carbone
Cu : cuivre
Ca : calcium
5. Non
6. Une molécule est un assemblage de 2 atomes ou plus donc il y a une infinité de molécules différentes.
2. Chp V : Les atomes et la transformation chimiques
I. Les molécules et les atomes
Une molécule est un assemblage d'atomes.
On représente les atomes par des symboles.
L'ensemble des atomes de l'Univers est présent dans le tableau périodique des éléments.
On modélise les atomes par des boules de différentes couleurs.
| Nom de la molécule | Formule | Modèle |
| Dioxygène | O2 | 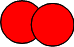 |
| Eau | H2 O | 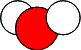 |
| Méthane | CH4 | 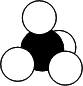 |
| Carbone (il est seul, c'est un atome, pas une molécule !) | C |  |
| Dioxyde de carbone | CO2 |  |
| Diazote | N2 |  |
La formule d'une molécule renseigne sur sa composition.
II. Modélisation d'une transformation chimique
1. La masse et la réaction chimique
La craie disparaît et il y a une effervescence qui montre qu'un gaz se produit : une réaction chimique a lieu. La masse totale ne varie pas. Les atomes présents dans les produits sont ceux qui composaient les réactifs.
Lors d'une réaction chimique, il y a conservation des atomes donc de la masse.
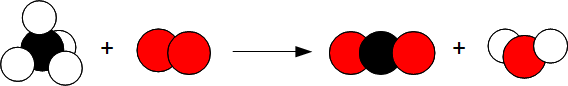
2.2. Combustion du carbone
2.3. Combustion du méthane
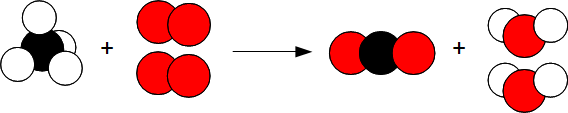
Lors de la combustion du méthane dans le dioxygène, il se produit du dioxyde de carbone et de l'eau.
CH4 + O2 —> CO2 + H2 O
Il y a un problème : 1 atome d'oxygène a disparu et 2 atomes d'hydogène ont disparus. Or la masse se conserve lors d'une réaction chimique donc les atomes ne peuvent pas apparaître ni disparaître.
En réalité il se passe la réaction suivante :
Donc
CH4 + 2 O2 —> CO2 + 2 H2 O
2.4. Combustion du fer
Le fer brûle dans le dioxygène pour former un oxyde de fer.*
Fe + O2 —> Fe3 O4
après équilibrage :
3Fe + 2O2 —> Fe3 O4