Chapitre III : Acides, bases et transformations chimiques
I. Mesure de pH de quelques solutions usuelles
Le pH se mesure avec un pHmètre ou un indicateur coloré.
pH mètre :
Papier pH :
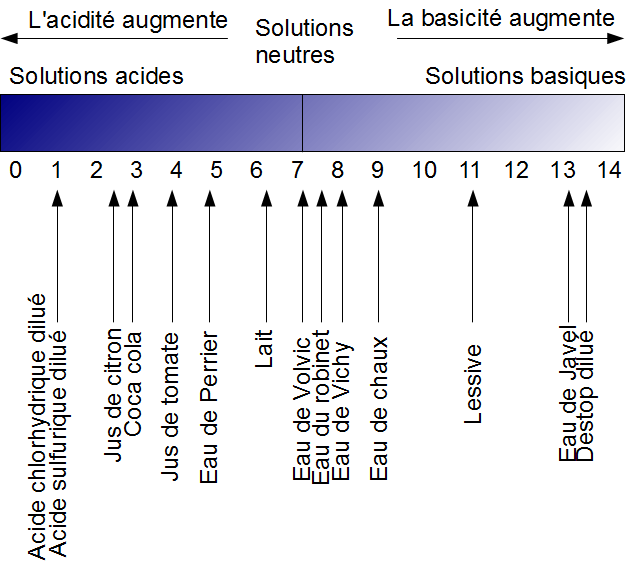
Le pH d'une solution aqueuse est une grandeur sans unité qui précise le caractère acide (0 ≤ pH < 7), neutre (pH = 7) ou basique (7 < pH ≤ 14).
Le pH d'une solution aqueuse est un nombre toujours compris entre 0 et 14.
Le Coca Cola est un acide.
Le Coca Cola est acide.
La soude est une base.
La soude est basique.
II. Quelle est l'origine de l'acidité ou de la basicité ?
Le responsable de l'acidité d'une solution aqueuse est l'ion hydrogène. Le responsable de la basicité est l'ion hydroxyde.
Une solution chimiquement neutre contient, parmi un très grand nombre de molécules d'eau, autant d'ions H+ que d'ions HO- .
Une solution acide contient beaucoup plus d'ions H+ que d'ions HO- ; une solution basique contient beaucoup moins d'ions H+ que d'ions HO- .
Le Coca Cola contient plus d'ions hydrogène que d'ions hydroxyde.
La soude contient plus d'ions hydroxyde que d'ions hydrogène.
III. Précaution à prendre avec les acides et les bases
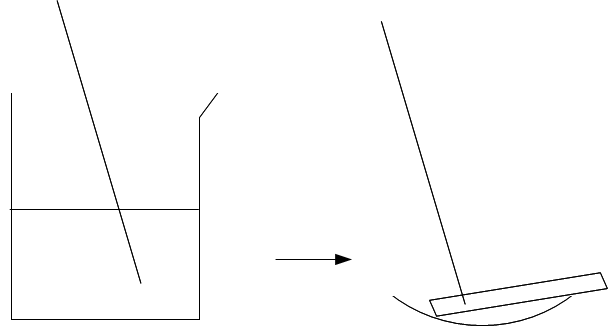
Certains acides, comme l'acide chlorhydrique, sont dangereux. Leur dilution dans l'eau est très exothermique (dégage beaucoup de chaleur). C'est pourquoi, pour effectuer une dilution, il faut toujours verser, avec beaucoup de précautions, l'acide dans l'eau, mais JAMAIS l'inverse. Il en est exactement de même pour les bases.
On ne donne pas à boire à un acide.
Les solutions acides ou basiques concentrées sont corrosives.
Consignes de sécurité:
- L'usage de gants et de lunettes de protection est nécessaire.
- Éviter tout contact avec la peau, les yeux.
- Ne jamais mélanger à d'autres produits dans l'ignorance.
- Ne pas évacuer dans l'évier de solutions très concentrées.
IV. Dilution d'une solution acide.
Lors d'une dilution d'une solution acide, le pH augmente. Il atteint au maximum la valeur pH = 7.
V. Transformation chimique
1. Quels sont les ions présents dans l'acide chlorhydrique ?
Les ions présents dans l'acide chlorhydrique sont :
- l'ion hydrogène H+
- l'ion chlorure Cl-
2. Réaction chimique entre le fer et l'acide chlorhydrique
Rappel de 4ème :
Lors d'une réaction chimique, les réactifs disparaissent et les produits se forment.
Réactifs $\rightarrow$ Produits
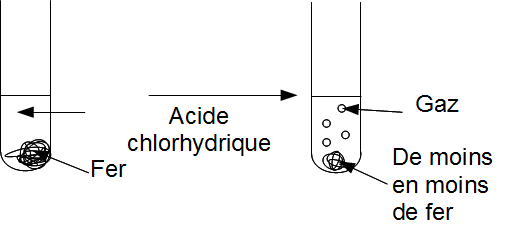
On observe qu'un gaz se forme (c'est donc un produit).
On observe que le fer disparaît (c'est donc un réactif).
2.1. Quel est le nom du gaz formé ?
- Est-ce du dioxyde de carbone ? CO2
Non, ce n'est pas possible car il n'y a pas d'atomes de carbone dans les réactifs. Il ne peut donc pas y avoir d'atomes de carbone dans les produits.
On aurait pu tester la présence de dioxyde de carbone en ajoutant de l'eau de chaux. Cette dernière ne se serait pas troublée.
- Est-ce du dioxygène ? O2
Le test de la bûchette incandescente montre que ce gaz n'est pas du dioxygène.
- Est-ce du méthane ? CH4
Non, ce n'est pas possible car il n'y a pas d'atomes de carbone dans les réactifs. Il ne peut donc pas y avoir d'atomes de carbone dans les produits.
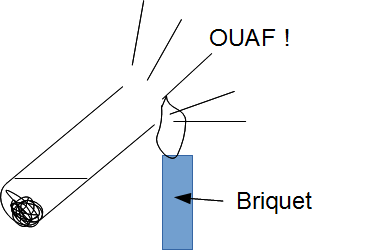
Ce gaz est du dihydrogène. H2
On le met en évidence à l'aide du test du « cri du chien »
2.2. Où est passé le fer ?
Le fer se dissous dans l'acide chlorhydrique. Il se transforme en ion. Quel ions ? Fe2+ ou Fe3+ ?
Après dilution, on rajoute quelques gouttes de soude. On obtient un précipité vert qui montre que l'ion fer II s'est formé.
2.3. Les ions hydrogènes.
Si on mesure le pH, on observe que le pH augmente.
On en déduit que le nombre d'ion hydrogène diminue. C'est donc un réactif.
2.4. Les ions chlorures
Le test au nitrate d'argent montre que les ions chlorures sont présents avant et après la réaction chimique. Ils n'interviennent pas dans la réaction chimique.
Bilan :
fer + acide chlorhydrique $\rightarrow$ dihydrogène + chlorure de fer II
réactifs produits
Le fer réagit avec l'acide chlorhydrique pour former du dihydrogène et du chlorure de fer II.
Divers
Acide Base : dissolution exothermique d'une pomme
En animation :