Exercice 9 p 41
a. On rajoute de la soude dans les 3 tubes à essai.
b. On obtient un précipité vert après ajout de soude, cela signifie que l'ion fer II (formule Fe2+ ) est présent.
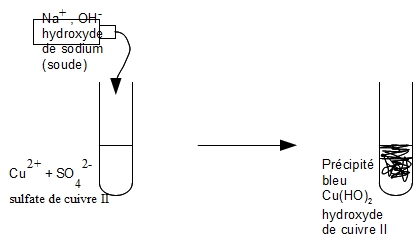
On obtient un précipité bleu après ajout de soude, cela signifie que l'ion cuivre II (formule Cu2+ ) est présent.
On obtient un précipité rouille après ajout de soude, cela signifie que l'ion fer III (formule Fe3+ ) est présent.
Exercice 12 p 41
a. On observe un précipité blanc
b. On ne peut donc pas utiliser ce test pour identifier l'ion aluminium puisqu'on obtient un précipité blanc dans les 2 cas.
Exercice 13 p 42
Dans le premier tube, on obtient un précipité blanc en présence de nitrate d'argent. L'ion chlorure est donc présent.
Dans le 2ème tube, on n'obtient pas de précipité en présence de soude. On peut conclure :
- qu'il n'y a pas d'ion cuivre II sinon on aurait eu un précipité bleu.
- qu'il n'y a pas d'ion fer II sinon on aurait eu un précipité vert.
- qu'il n'y a pas d'ion fer III sinon on aurait eu un précipité rouille.
Exercice 16 p 42
a. HCO3 signifie qu'il y a 1 atome d'hydrogène, 1 atome de carbone et 3 atomes d'oxygène.
(rappel : H2 O signifie que cette molécule est composée de 2 atomes d'hydrogène et 1 atome d'oxygène)
b. La charge de l'ion $HCO_3^-$ est 1- (1 seule charge négative, le 3 signifie qu'il y a 3 atomes d'oxygène).