Chapitre II : La constitution de la matière
I. Le modèle moléculaire
Les molécules sont des particules très petites (de l'ordre du nanomètre 1nm = 10-9 m ) constituant la matière.
Un corps pur est constitué de molécules identiques.
Ex : l'eau pure est constituée exclusivement de molécules d'eau toutes identiques entre elles.
Un mélange est constitué de molécules différentes.
Ex : l'eau salée est composé de molécules d'eau et de molécules de sel.
II. Les états de la matière
1. L'état gazeux
Dans un gaz, les molécules sont éloignées les unes des autres.
Elles bougent de façon désordonnée. Entre les molécules, il y a du vide.
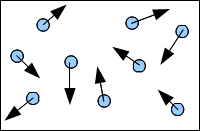
2. L'état liquide
Dans un liquide, les molécules se touchent mais se déplacent les unes par rapport aux autres.
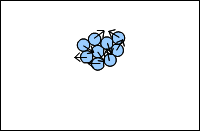
3. l'état solide
Dans un solide, les molécules se touchent et sont immobiles.
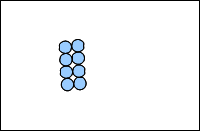
En résumé :
1. La compressibilité d'un gaz
Les molécules peuvent se rapprocher. Leur nombre ne change pas car la seringue est fermée.

2. L'incompressibilité d'un liquide ou d'un solide
Les molécules ne peuvent pas se rapprocher davantage.
Leur nombre ne change pas car la seringue est fermée.

3. Comportement de la seringue
Pourquoi le piston revient en place tout seul ?
Animation JP Fornat : https://www.pccl.fr/physique_chimie_college_lycee/quatrieme/chimie/air_pression.htm
4. Conservation de la masse lors d'un mélange eau sel
5. Conservation de la masse lors de la fusion d'un glaçon
La masse ne varie pas car le nombre de molécule ne change pas.
6. Pourquoi le linge sèche plus vite quand on il y a du vent
8. Eau liquide qui devient de la vapeur
9. Un parfum se diffuse tout seul dans une salle
10. 2 gaz se mélangent
11. 2 liquides qui se mélangent