Exercice 2 p 25
| | | | | | | P | O | S | I | T | I | F | | |
| | | N | E | U | T | R | O | N | | | | | | |
| | N | U | C | L | E | O | N | S | | | | | | |
| | | | N | E | U | T | R | E | | | | | | |
| E | L | E | C | T | R | O | N | | | | | | | |
| | | | | | | N | O | Y | A | U | | | | |
Ex 4 p 26
a. Elle se situe dans le noyau. Elles sont portées par les protons.
b. Un atome est neutre. Il doit donc y avoir le même nombre de charge plus et de charges moins. Il y a donc 6 électrons qui portent chacun une charge moins.
Ex 5 p 26
a. Hugo a raison car dans un atome, il y a autant d'électrons que de protons (autant de charges moins que de charges plus car l'atome est globalement neutre)
b. Il y a un électron de trop dans la représentation de Lisa : l'ensemble n'est pas neutre.
Ex 8 p 26
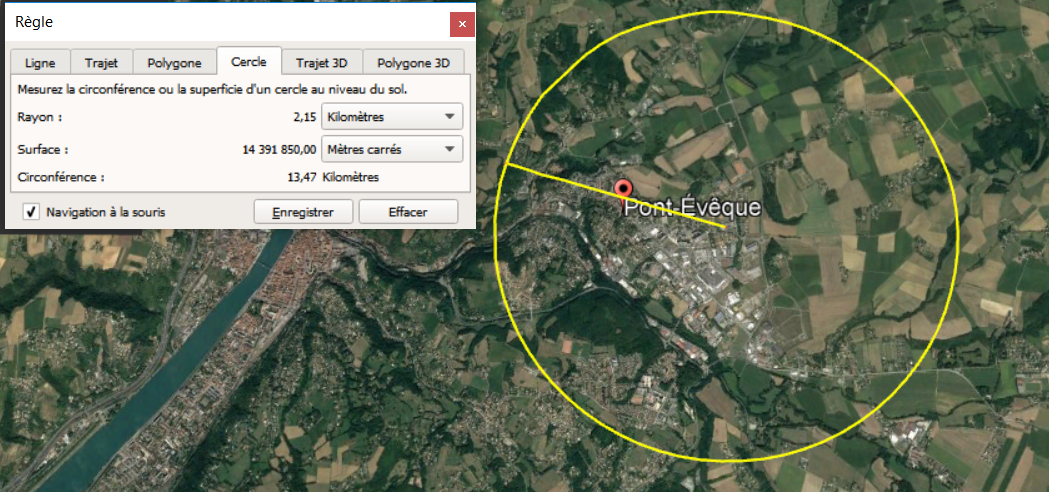
Si le noyau était gros comme une balle de golf, l'atome serait 100 000 fois plus gros, c'est à dire :
$43mm \times 100 000 = 4 300 000mm = 4,3km$
C'est plus grand que Pont Evêque !
.